KAIST는 생명과학과 정인경 교수와 기초과학연구원(IBS) 혈관 연구단 정원석 부연구단장(겸 KAIST 생명과학과 교수) 공동연구팀이 별아교세포 발달 과정에서 특정 유전자가 성인기 뇌 면역 반응을 조절하는 핵심 역할을 한다는 사실을 세계 최초로 규명했다고 24일 밝혔다.
이번 연구는 치매, 알츠하이머병 등 퇴행성 뇌 질환의 원인 규명과 치료 전략 수립에 중요한 단서를 제공할 것으로 평가된다. 연구팀은 쥐 모델을 이용해 뇌·척수에서 높은 비중을 차지하는 별아교세포의 발달 시기별 유전자 조절 프로그램을 분석했다. 그 결과, ‘NR3C1(Glucocorticoid Receptor)’ 유전자가 출생 직후 발달 단계에서 장기적 면역 반응 억제의 핵심 조절자임을 밝혀냈다.
특히 최신 ‘3차원 후성유전체 분석 기술’을 적용해 전사체, 염색질 접근성, 3차원 게놈 상호작용을 통합 분석한 결과, 발달 과정에서 55개의 주요 전사인자를 찾아냈고, 이 가운데 NR3C1이 아기 뇌 발달 초기에 면역 스위치 역할을 한다는 점이 확인됐다.
NR3C1 유전자가 없는 경우 어린 시기에는 뇌 발달에 큰 문제가 없었지만, 성인기 자가면역성 뇌 질환이 발생하면 과도한 염증 반응이 나타나 병이 심각해졌다. 연구팀은 NR3C1이 아기 뇌에서 면역 스위치를 ‘예열’하는 역할을 하며, 이를 통해 성인이 된 뒤 과도한 면역 반응을 억제한다고 설명했다.
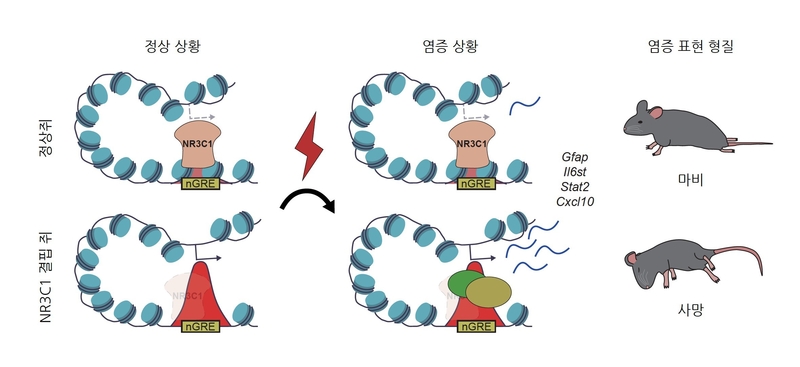
정원석 IBS 부연구단장은 “별아교세포의 면역 기능이 후성유전적 기억에 의해 조절된다는 사실을 처음 규명했다”며 “향후 알츠하이머병 등 뇌 질환 원인 규명에 기여할 것”이라고 말했다.
정인경 KAIST 교수는 “별아교세포 발달 시기의 후성유전적 조절이 성인기 뇌 질환 취약성을 좌우할 수 있음을 보여줬다”며 “3차원 게놈 연구가 다발성경화증(MS) 등 면역성 뇌 질환 치료 전략 개발로 이어질 것”이라고 밝혔다.
이번 연구는 KAIST 박성완 박사와 박현지 박사과정생이 제1저자로 참여했으며, 국제학술지 네이처 커뮤니케이션스(Nature Communications) 9월 22일자 온라인판에 게재됐다. 또한 해당 저널은 9월 17일 이번 연구를 소개하는 해설 글을 실었다. 연구는 서경배과학재단, 보건복지부, 과학기술정보통신부, IBS의 지원을 받아 수행됐다.
헬로티 이창현 기자 |