전 NBC 뉴스 기자 찰스 서빈과 미국의 전설적 포크 가수 우디 거스리의 공통점은 희귀 유전성 질환인 헌팅턴병을 앓았다는 점이다. 헌팅턴병은 근육 조정 능력 상실, 인지 기능 저하, 정신적 문제를 동반하는 대표적 신경계 퇴행성 질환이다. KAIST 연구팀이 이 병의 원인 단백질인 헌팅틴 단백질의 새로운 기능을 규명하며 발병 원인 이해에 중요한 단서를 제공했다.
KAIST는 생명과학과 송지준 교수 연구팀이 오스트리아 과학기술원, 프랑스 소르본느대·파리 뇌연구원, 스위스 연방공대 등과 함께 국제 공동연구를 진행해 헌팅틴 단백질이 세포골격 미세섬유(F-actin)를 다발 형태로 배열하는 구조적 원리를 밝혀냈다고 16일 밝혔다. 연구팀은 초저온 전자현미경(cryo-EM)과 세포생물학적 기법을 활용했다.
기존에는 헌팅틴 단백질이 소포 운반이나 미세소관 수송에 관여하는 등 세포골격을 ‘활용’하는 역할만 한다고 알려져 있었지만, 이번 연구는 헌팅틴 단백질이 세포골격 자체를 물리적으로 조직한다는 사실을 세계 최초로 입증했다.
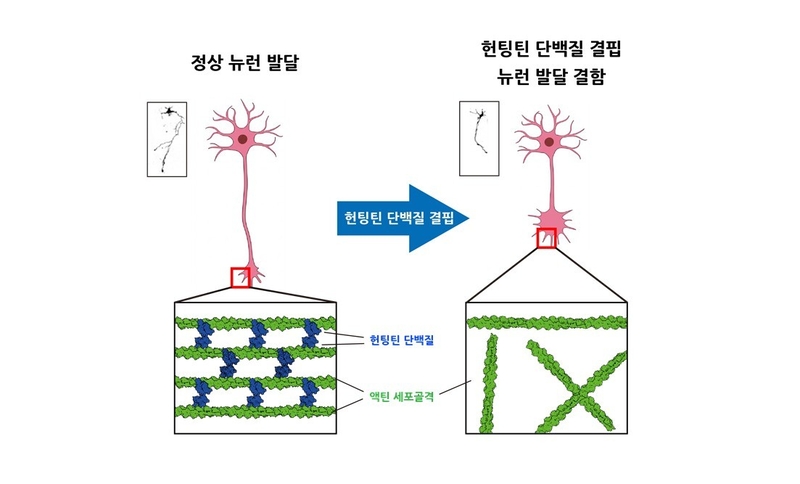
연구팀은 헌팅틴 단백질이 F-actin에 직접 결합하고, 두 단백질이 짝을 이뤄 약 20나노미터 간격으로 세포골격을 다발 형태로 묶는다는 사실을 확인했다. 이렇게 형성된 세포골격 다발은 신경세포 간 연결망 발달에 핵심적 역할을 하며, 실제로 헌팅틴 단백질이 결핍된 신경세포에서는 구조적 발달이 저해되는 현상이 관찰됐다.
김재성 KAIST 박사과정생은 “이번 연구는 불치병으로 알려진 헌팅턴병 원인 단백질의 작용 기전을 새롭게 이해하는 계기를 마련했다”고 말했다. 송지준 교수는 “이번 성과는 헌팅턴병 발병 메커니즘 규명뿐 아니라 세포골격 관련 질환 연구에도 파급력이 클 것”이라며 “세포 분열, 이동, 기계적 신호 전달 등 다양한 생명 현상에서 헌팅틴 단백질의 역할을 새롭게 조명할 수 있다”고 강조했다.
이번 연구는 KAIST 김재성 박사과정생과 김형주 박사(현 하버드대), 파리 뇌연구원 레미 카펜티어 연구원, 마리아 크리스티나 가피치 연구원 등이 제1 저자로 참여했으며, 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 9월 19일 자에 게재됐다. 연구는 보건복지부 글로벌연구협력지원사업(한-스위스 바이오헬스 국제공동연구)과 한-오스트리아 협력기반조성사업의 지원을 받아 수행됐다.
헬로티 이창현 기자 |