나노 소재와 바이오 물질을 이용해 우수한 생체 안정성 달성
최근 신체에 착용하거나 부착해 생체 정보를 모니터링하고 건강을 관리할 수 있는 웨어러블 디바이스에 대한 관심이 급격히 증가하고 있다.
지금까지 개발된 웨어러블 센서는 주로 인체의 움직임이나 물리적인 정보들을 모니터링하는 것이 주류였다. 반면에 인체에 부착해 눈물, 땀 등 생체 용액을 분석함으로써 건강지표와 관련된 화학적인 정보를 얻을 수 있는 웨어러블 센싱 플랫폼 기술은 상대적으로 그 개발 속도가 뒤처졌다.
이는 인체에 부착해서 생체 용액을 분석하고 모니터링하는 웨어러블 바이오센서의 경우, 선택성과 민감도뿐 아니라 신체 안정성과 기계적 유연성이 동시에 만족돼야 하므로 이를 구현하는 데 기술적으로 어려움이 있었기 때문이다.
이와 관련, 한국과학기술연구원(KIST)의 스핀융합연구단 이현정 박사팀은 나노 소재와 바이오 물질을 이용해 인체 안정성이 높고 선택성과 민감도가 뛰어난 유연 바이오 센싱 플랫폼 기술을 개발했다.
눈물, 땀, 타액 등의 생체 용액은 건강 상태와 관련된 생체 지표들(바이오마커)을 많이 포함하고 있다고 알려져 있다. 인체에 부착하거나 착용하여 생체 용액을 분석하고 바이오 마커 정보를 주고받을 수 있는 웨어러블 바이오센서 기술은 전 세계 기업, 연구소, 대학 등에서 활발히 개발되고 있다.
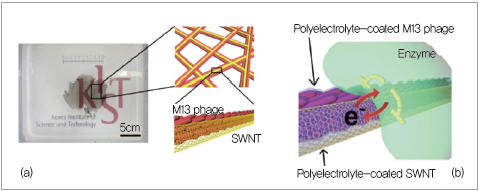
▲ 그림 1. 개략적인 나노 구조
(a) 효소와 직접 전자를 주고받기 위해 나노전극으로 사용한 나노메시 소재의 이미지와 나노 구조
(b) 나노메시 기반 효소전극 플랫폼의 나노 구조. 전자를 주고받을 수 있는 효소(Enzyme)가 고분자 전해질
층(Polyelectrolyte)을 통해 나노메시에 접촉돼 있다. 나노메시에서 단겹탄소나노튜브는 전기를 통하게
하는 나노 전극 역할을 하며, M13 phage 바이오 물질은 나노메시의 나노 구조를 제어할 뿐 아니라 대면
적 나노메시 구조를 유지하고 안정화하는 역할도 한다. 또한 표면에 전하를 띠고 있어 고분자 전해질 층
을 이용해 효소를 고정화시키는 역할도 한다.
생체 내 바이오 마커와 결합되는 효소들은 바이오 마커와 전자를 직접 주고받을 수 있는 산화환원센터를 갖고 있는 경우가 많다. 기존에 널리 사용되던 효소 기반 바이오센서는 화학적 매개체를 통해 산화환원센터로부터 전자를 전극으로 전달 받았는데(제2세대 바이오센서), 이 전자 매개체로 사용되는 물질은 대부분 독성이 높은 화학 물질이어서 인체에 적용하는 웨어러블 디바이스에 적용하는 데 한계가 있었다.
반면에 효소의 산화환원센터[Enzyme Redox Center. 효소의 촉매 반응(Catalytic Activity) 혹은 산화환원반응이 실질적으로 일어나는 곳. 효소의 산화환원센터는 전자를 주고(산화) 받을(환원) 수 있는 화합물이나 전이금속이온을 포함하고 있어 효소의 촉매 반응 혹은 효소의 산화환원반응을 돕는다]와 직접-전자-전달(Direct-Electron-Transfer, DET. 효소의 산화환원센터와 전극이 매개체 없이 직접적으로 전자를 주고받는 것을 말한다.
효소와 전극이 직접 전자를 주고받는 반응 크기는 효소와 선택적으로 반응하는 바이오 마커의 유무에 따라 그 정도가 바뀌는데, 이러한 원리에 기반한 바이오센서를 제3세대 바이오센서라고 한다.
제3세대 바이오센서는 인체에 유해한 화학적 매개체를 사용하지 않고, 동작 전압이 낮아 방해인자요소에도 둔감하므로 고선택성, 인체 안정성 면에서 유리하다) 방식을 이용하는 제3세대 바이오센서의 경우 인체 안정성이 높다고 알려져 있다.
그러나 DET 방식의 제3세대 바이오센서는 효소의 산화환원센터와 전극 간 저항이 높기 때문에 전자 전달 효율이 낮다는 것이 큰 문제였다. 특히 눈물, 땀, 타액 등 생체 용액 내의 건강지표 인자들은 혈액 내에 존재할 때보다 농도가 수십 배 이상 낮은 경우가 많아, 전자 전달 효율이 낮은 DET 방식을 적용하기가 더욱 어려웠다.
나노전자소재를 전극으로 이용하면 효소와 긴밀한 전기적 접촉이 가능해 효소와 전극 간 저항을 낮추므로 직접적인 전자 전달 효율을 높일 수 있다. 그러나 기존 나노 소재 기반의 효소 전극 공정은 전극을 기능화시키는 과정에서 전극의 전기적 특성이 저하되는 경우가 많기 때문에, 효율이 낮거나 유연집적소자공정에 적합하지 않아 웨어러블 디바이스에 적용하기 어려웠다.
이현정 박사팀은 고전도성 나노전자소재인 단겹탄소나노튜브와 강한 결합력을 가진 실 모양의 바이오 물질을 이용해(M13 박테리오파지) 단겹탄소나노튜브를 나노그물 구조의 대면적 전도성 나노메시 전극으로 형성하고, 고분자 전해질 층을 이용해 효소를 나노메시 전극과 결합시켜 전자 전달 효율이 높은 나노메시 효소전극을 개발했다.
나노메시 전극은 기계적인 유연성이 뛰어나고 수용액에서 대면적으로 형성되므로 단순한 공정으로 유연소자를 제작할 수 있다. 또한 연구진이 개발한 바이오 물질은 수용액에서 음전하를 띠고 있어, 반대 전하를 띠는 고분자 전해질 층을 이용해 효소를 나노메시 전극에 효율적으로 고정화시킬 수 있었다.

연구팀이 개발한 나노메시 효소전극을 이용한 제3세대 글루코스센서는 민감도가 세계적인 수준의 값이었으며, 특히 제 3세대 유연글루코스센서도 비슷한 수준의 민감도를 보임으로써 차세대 헬스케어용 웨어러블 바이오센서로의 적용 가능성을 높였다.
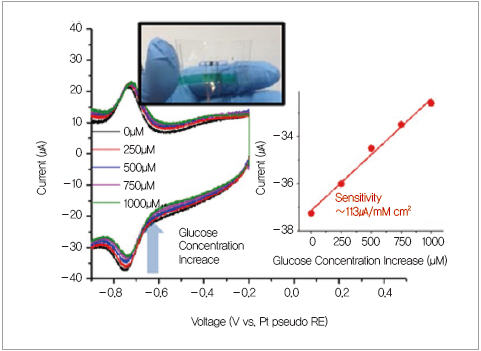
▲ 그림 2. 나노메시 효소전극을 이용한 제3세대 유연 글루코스센서
(글루코스의 양이 증가할수록 직접 전자 전달에 의한 전류 크기가 줄어드는데, 그 정도가 글루코스의 양에
비례하는 것을 이용해 글루코스센서를 구현할 수 있다. 나노메시 효소 전극 기반 글루코스센서는 유연할 뿐
아니라 방해 물질에 대해 선택성이 뛰어나고 감도가 좋아 눈물, 땀과 같은 생체 용액 내에서 낮은 농도를
지닌 표적 물질만 모니터링할 수 있는 고성능 웨어러블 센서로 유용하게 응용될 수 있다)
연구팀은 개발한 나노메시 효소전극 기술을 적용해 글루코스센서에 쓰이는 글루코스옥시다아제 효소를 비롯, 콜레스테롤 옥시다아제, 락테이트 옥시다아제 등 총 8가지 다른 효소에 대해 전자를 직접 주고받을 수 있다는 것을 증명했다.
또한 나노메시 효소 플랫폼은 바이오 플루이드 내 주요 방해 인자들로 알려진 아스코르브산(Ascorbic Acid), 요산(Uric Acid), 아세트아미노펜(Acetaminophen) 등에 반응하지 않아, 바이오센서의 가장 큰 이슈 중 하나인 선택성 측면에서도 뛰어난 특성을 나타냈다.
따라서 이 연구를 통해 개발된 기술을 적용한 웨어러블 디바이스를 이용하면 글루코스뿐 아니라 젖산, 콜레스테롤, 과산화수소 등 여러 건강지표 인자들을 효과적으로 모니터링할 수 있을 것으로 기대된다.
정리 : 김희성 기자 (npnted@hellot.net)
Copyright ⓒ 첨단 & Hellot.net
